Enthalpy референтна система
Термодинамичните методи е невъзможно да се намери на абсолютните стойности на енталпията и вътрешна енергия, и могат да се определят само да ги промените. В същото време, термодинамичните изчисленията на химически реактивни системи е удобно да се използва един координатна система. Тук, тъй като енталпия и вътрешната енергия са взаимосвързани. достатъчно е да се въведе система за отправна точка за един от най-енталпия. Също така, за сравнение и подреждане на термичните ефекти на химични реакции, които зависят от състоянието на реагентите и просмукване на XP условия, понятието стандартен състояние на материята. Според препоръката на Комисията за термодинамиката на Международния съюз за чиста и приложна химия (IUPAC) през 1975 г., стандартната състояние се определя, както следва:
"Стандартната състояние е състояние, за газове хипотетичен идеален газ при налягане от 1 атмосфера физически (101325 Ра). За твърди вещества и течности стандартната състояние е състояние на чист течен или чист кристален материал, съответно в атмосфера 1fizicheskuyu налягане. За вещества в разтвори за хипотетичен стандартно състояние приема състоянието, в което моларното енталпия на разтвор (1 мол вещество в 1 кг разтворител) да бъде равен на енталпия на разтвор в безкраен разреждане. Свойства на веществата при стандартни условия, определени от горен индекс 0 ". (Чисто вещество, наречено вещество се състои от същите структурни частици (атоми, молекули и т.н.)).
Това определение се казва условия хипотетичен газ и разтворените, защото в актуално състояние на газ в по-голяма или по-малка степен се различава от идеала и състоянието на решения - от идеално решение. Ето защо, когато се използва термодинамичните свойства на веществата, при стандартни условия се коригират с реалните условия на отклонение от тези имоти от действителните. Ако тези отклонения са малки, изменението не може да влезе.
термодинамични стойности директории обикновено са при стандартни условия: р = 0 налягане 101325Pa и температура T0 на = T0 = 0 К или 298,15K (25 0 ° С). При създаване на таблици, пълни енталпиите вещества като референтния енталпията тя също е приета стандартно състояние при температура T0 = T0 = 0 K или 298,15K.
Ние вещества. чисти химични елементи са в най-стабилната фаза състояние за р = 0 101325Pa и температура T0 на енталпии на произход. поеме стойност енталпия на нула. , (Например, вещества в газообразно състояние: O2 N2 Н2 Cl2 F2 и т.н. за C (графит) и метални (твърди кристали) .....).
За химични съединения (СО2. Н2 О и т.н.) и за вещества, които са чисто химически елементи, които не са в най-стабилно състояние (О, N и др.) Енталпия когато р = 0 и 101325Pa T0ne нула. ,
Енталпия на химични съединения, когато р 0 и T0 е определено равно на термичния ефект от образуването на чисти химични елементи на тези параметри, т.е. , Например, при T0 = 0 К: и T0 = 298,15K :.
Енталпията на всяко вещество, при температура Т е равно на количеството топлина, което е необходимо да се въвеждат в изобарен процес да се изчисти химични елементи при температура T0 за получаване на веществото и се загрява до температура T0 на, т.е. температура Т. формула за изчисляване на енталпията на всяко вещество има следния вид:
. или ние имаме най-икономична записване:
където Superscript "о" означава, че веществото е в стандартната състояние при р = 0 101325Pa; - образуване на енталпията на веществото при температура T0 на чисти химични елементи; = - излишък енталпия свързани с топлинния капацитет на веществото, - общата енталпия, като се вземат предвид енталпията на веществото.
Схема енталпията при температура Т могат да бъдат представени като:
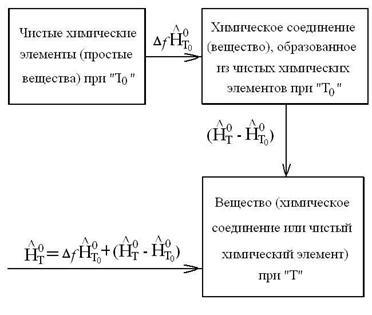
По отношение на различните отделните вещества са представени количества: и излишъкът енталпия за различни температури Тс.
Тъй като излишък енталпия на отделните вещества в таблиците не са дадени, след това лявата страна на експресията на най-T0 = 298,15K необходимо да се добавят и изважда топлина на образуване на материал при температура T0 = 0k. Тогава ние се получи излишък енталпия. които се съдържат в таблиците и допълнителен срок. равна на разликата в топлина на образуване при температури T0 = 298К и T0 = 0 К; т.е. , Тогава ние имаме:
Пълен енталпия изчислява отношения за T0 и T0 = 0 К = 298,15K имат еднаква стойност за веществото при дадена температура Т.