Относно №6 «електрохимични процеси"
Стандартни електродни потенциали на метали. Получаване на двоен електрически слой и потенциала на електрода в интерфейса на метал-електролит. Уравнението на Нернст.
Видове електроди. EMF на галванични клетки и максимална работа. Редокс потенциал. Посока окислително-редукционни реакции.
Електролиза на електролитни разтвори и стопилки. Редът на окислението и намаляване на електродите. Електролиза с инертен и разтворим анод. закон на Фарадей. Сегашната ефективност. потенциал експанзия. Пренапрежение.
Практическото приложение на електрохимически процеси в областта. Източници на електрическа енергия: galvanoelementy и батерии. Използването на електролиза в областта. Катодна и анодните процеси.
Има една много тясна връзка между химични и електрически явления, изучава химия, защото повечето явления е електрическо в природата. Такива събития включват, например, водородно свързване, хидратация процеси на йонизация, асоциация, комплексообразуване, и накрая, реакцията на окисление-редукция.
Въпреки това, всички тези процеси не могат да бъдат приписани на редица електрохимична, защото те не са придружени от вътрешно превръщане на електрическа и химическа енергия. Например, ако реакцията на редокс се извършва в същия разтвор, системата не произвежда електрическа работа, тъй като общият ток поради електронен трансфер от редуциращия агент за окислител, е равна на нула (поради хаотично движение на електрони и йони).
Ако катодните и анодните процеси пространствено разделени (както е направено в клетката), след това чрез затваряне на външната верига, електроните napravlennoeperemeschenie от анода към катода (т.е., електрически ток) и извършва разтвор посока движението на йоните от катода към анода.
Така, за да включва само тези електрохимически реакции редокс, които причиняват електрически ток или да се появят под въздействието на електрически ток. Първият тип реакция се провежда в електрохимични клетки - миниатюрни батерии и висока мощност батерии за електрически превозни средства, водород горивни клетки осигуряват електроенергия космически кораби - (в която енергията на химическа реакция се превръща в електрическа енергия), втори тип - в електролитни клетки (за които електрическа енергия се превръща в химично ).
Стандартни електродни потенциали на метали.
През 1865 г. (т.е. 4 години преди откриването на закона чрез периодични DI Менделеев) метали са били класифицирани според тяхната дейност. Той е известен български учен NN Бекетов, който изследва ефекта на различни метали в разредени киселини и вода и се забеляза, че най-активно държат на алкални метали. Някои от същите метали като Cu, Hg, Ag, Au, не водород се измества от киселинни разтвори, напротив - по себе си е в състояние да измести водородът от метален живак и сребърни соли.
Резултатът от произведенията на NN Beketova се нарича изместване гама от метали:
K, Na, Са, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, Н2. Cu, Hg, Ag, Au.
Всички метали, обърнат наляво в този ред водород изместват водород от разредени киселини.
Модерният името на поредицата - "Електрохимични серия напрежение", тъй като позицията на всеки метал в тази серия се определя от така nazyvaemogoelektrodnogo потенциал.
Какъв е потенциалът на електрода? Как се случи?
Припомнете chtoelektricheskim количество potentsialomnazyvayut съответстваща на енергия, която трябва да се изразходват (и след положителен потенциал) или който може да бъде получен (и след това отрицателен потенциал) за прехвърляне на единица количество електроенергия от безкрайност до дадена точка.
Според настоящите изглед, възлите на кристалните решетки метали са атоми и йони, и неутрални атоми са много малки, по-голямата част от частиците са под формата на йони. Електроните, подчиняващи се на законите на квантовата теория, се движат в областта на положителни заряди, създавайки един вид "електронен газ". Следователно, налице е динамично равновесие метал, който може да бъде изразена чрез уравнението.
Ако металната плоча е потопен във вода, след това под действието на полярните молекули вода порциите катиони се в течност Me Z + + MH2 О ↔ [Me (Н2 О) т] + Z. докато електроните остават върху металната плоча, при което металът е зареден отрицателно.
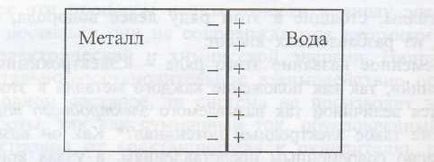
Катиони, които са паднали в течността, са разположени близо до повърхността на отрицателно зареден метална плоча, при което се образува електрически двоен слой. който може да бъде представен схематично както следва (Фигура 1):
Фиг.1. електрически двоен слой на метал водата
По този начин, на границата на течния метал електрически контакт с промени potentsialφrezko и nablyudaetsyaskachok (или разлика) potentsialaΔφ които взети nazyvatelektrodnym потенциал.
В най-съвременната химическа литература обозначени prostoφ потенциални скокове.
Ясно е, че по-активен метал, по-лесно ще се дисоциира атоми, повече катиони отиват в течността и следователно ще bόlshim отрицателен заряд на метал, което от своя страна ще доведе bόlshuyu потенциална разлика в метални течен интерфейс.
Процесът на преминаване метални йони в течността е обратим процес. Ето защо, ако металната плоча не се потопи във водата, и в разтвора на метална сол, равновесието се измества: метал в разтвора ще премине по-малко йони и потенциалната разлика в метал решение ще бъде малко по-различно, отколкото в първия случай.
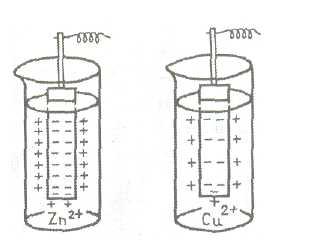
Фиг. 2 е диаграма на възникване на електрически двоен слой в случай на цинкови и медни плочи, потопени в разтворите на техните соли.
Фиг.2. Схема на потенциала на електрод
Може да се види, че стойността на потенциала на електрода се определя главно vsegoprirodoymetalla. Също така зависи от температурата, концентрацията и друго решение faktorov1. Следователно, за да сравните потенциалите на електродите е необходимо да се избере някои стандартни условия. Обикновено, сравнението се провежда при 25 ° С, налягане от 101,3 кРа и при концентрация в разтвор на същото име йон равна на единица (1 мол / л).
Така стандартната потенциал електрод се нарича потенциала електрод на метален йон концентрацията на 1 мол / л.
Абсолютната стойност на потенциала на електрода не може да бъде измерена (след въвеждането на всички проби, неизбежно води до появата на нов контакт потенциална разлика). Въпреки това, не съществува трудност otnositelnogoelektrodnogo измерване на капацитет.
Относителни метални електроди потенциали измерват спрямо стандартен водороден електрод потенциал е произволно взети като нула.
Тъй водород при температура 298 К е газ тях невъзможно като метална плоча за производство. Като твърд инертен метал (например Pt) се използва в стандартен водороден електрод.
Структурно водороден електрод (фиг.3) се състои от платина плака, покрита със слой от дребнозърнест платина - платина черна, частично потопен в разтвора киселина с водороден йон концентрация от 1 мол / л а. Обикновено вземат нелетлив киселина - сярна H 2SO 4 или перхлорна НСЮ4. За плоча служи чист водород газ при постоянно налягане от 101,3 кРа.
Появата на капацитета на стандартен водороден електрод може да бъде представена както следва. газ водород се абсорбира платина влиза атомен състояние, но в повърхностния слой на платина се уравновеси Н2 ↔ 2Н, но на границата на платина и сярна киселина - баланс Н ↔ Н + + напр.
Общият процес се изразява с уравнението:
По този начин, електрод водород може да бъде определен като Н2 / H +, Pt. където вертикалната линия показва интерфейса фаза.
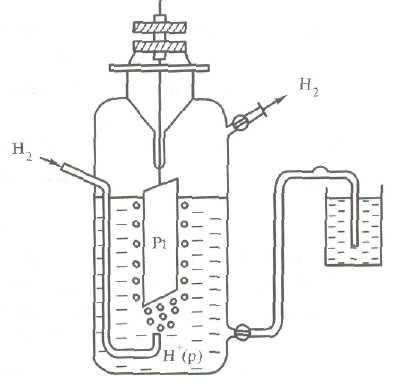
Фиг. 3. Схема водороден електрод или така
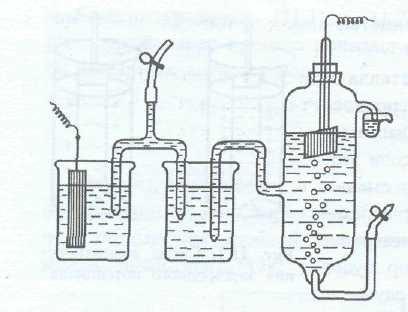
Ако метална плоча се потапя в солен разтвор с концентрация на метален йон на 1 мол / л, за свързване на електролит мост с водороден електрод (3), ние получаваме електрохимичната клетка. т.е. полученият електрически ток ще отиде система. поради raznostyuelektrodnyhpotentsialovvodorodnogoelektrodai izuchaemogometalla.
Че тази стойност - разликата на потенциала на електрода на анода и катода - в електродвижещата сила отворен (отключена) нарича галванична клетка (едн или Е) на елемента:
В zamknutomgalvanicheskom елемент. т.е. когато измерената стойност на тока в елемента (т.е., когато платина метал съединение с някои метален проводник), потенциалната разлика между катода и анода напрежение се нарича:
Директно измерване на потенциалната разлика на клемите на електрохимичната клетка, като се използва конвенционален волтметър може да се получи стойността на напрежението U, която не е равна на елемент EMF, т.е. U<ЭДС.
Разликата между електродвижещата сила и напрежение поради напрежението вътре в елемента чрез преминаване на ток (по физика EMF = I · R + I · rvnutr .. където rvnutr - Когато вътрешното съпротивление на електрода I.
0 продукт I · rvnutr .. = 0, но изразяването на R I · макар и много малка, но въпреки това все още е и EMF). Ето защо, измерване на метод едн обезщетение обикновено се извършва, в който токът през елемента е близо до нула. По-прост и по-точен метод за измерване на едн е директно измерване на напрежението на клемите на електрохимичната клетка с волтметър с високо съпротивление (високо омично волтметър). Поради високата устойчивост волтметър малък ток, преминаващ през елемент, така че не е много разлика между електродвижещото напрежение и напрежението в клетката.
EMF измерване верига се състои от стандартен водороден електрод и стандартната потенциал електрод на последната металната elektrodayavlyaetsya.
Ако измерване на стандартни електродни потенциали на различни метали в сравнение със стандартната потенциал водороден електрод и ги организира във възходящ ред, след това получаване на редица метали напрежения:
Няколко стрес характеризира химичните свойства на метали:
По-малкият размер на алгебрични φ0 има метал, така че е химически активен. т.е. по-голямата му устойчивостта.
По-нататъшното раздалечени в серия от две метални стрес, на bόlshuyu електродвижещата сила ще бъде изграден от тези електрохимична клетка, където катода винаги ще бъде потенциал електрод е по-голяма.