химичен еквивалент
До началото на ХIХ век е имало драматичен пробив в изучаването на количествени методи за изследване на веществата, което доведе до нова фундаментална промяна в науката като цяло и по химия и по-специално.
Резкият почивка в изследването на количествените методи за научни материали в началото на ХIХ век доведе до нова фундаментална промяна в науката като цяло и по-специално химия.
След откриването на закона за запазване на масата Лавоазие бе последвано от серия от нови количествени закони - стехиометрични закони.

Открит V.Rihterom закон потвърди присъдите на много химици, че химичните съединения не взаимодействат произволни, а в строго определени пропорции.
Теоретичната част
Концепцията за "химически еквивалент"
Химически еквивалент на (Е (C)) (съгласно препоръките на IUPAC) е условно или реален частиците е равен на или цяло число, кратно на по-малкия си съответната формула единица *:
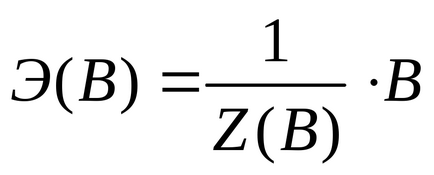
където V - единица дефинирани вещества: действително съществуващ частиците, като атом (Cu, Na, С) молекула (N2 HCI, КОН, Al2 (SO4) 3 CO2 ..), аниони -, катиони (ОН SO4 2-). (Си2 + К +.), радикали (С2 Н5 -NO2 -.), условни молекула кристални материали и полимери, всеки друг прахови частици;


Използване фактор еквивалентност като фракционна стойност по-малко удобно.
Еквивалентната броя Z е винаги по-голяма от или равна на 1 и е безразмерна; когато Z = 1 съответства на формула единица еквивалентно вещество.
Изчисляването на еквивалентен брой различни формула единици са представени в Таблица 1.1.
еквивалентен брой, и количествата следователно еквивалент зависят от химическа реакция, в която участват вещество.
* Преди разбира химически еквивалентно количество вещество, което допълва или замества един мол от водородни атоми в реакцията. Въпреки това, този термин се отнася не еквивалент, но количеството на материала еквивалент.
Реакциите на обмен. например чрез неутрализация на еквивалент фосфорна киселина към броя (еквивалент) на киселината варира в зависимост от пълнотата на реакцията:
Реакционната Н 3РО 4 + 3KOH → K3 РО4 + 3H2 О еквивалентен брой Z (Н 3РО 4) = = N (H +) = 3, тъй Реакционната включва три йон Н + фосфорна киселина и еквивалента на Н 3РО 4 ще бъде условна частиците 1 / 3H3 РО4 (Е (Н 3РО 4) = 1 / 3H3 РО4).
Таблица 1.1. Изчисление на еквивалентен chislaZveschestva.