Термодинамика на процеса - studopediya
Термодинамични процеси в идеалните газове
Термодинамика разглежда пет основни процеси на идеалните газове:
1. Хелмхолц. (V = конст) срещащи се в постоянен обем на газ;
2. Gibbs, (р = конст) срещащи се при постоянно налягане;
3. изотермични (Т = конст) с произход при постоянна темпера-кръг;
4. адиабатен. (Q = 0), преминаващ без снабдяване или отвеждане на топлина, т.е. протичащ без топлообмен с околната среда;
5. политропно - процес синтез на промяна на параметрите на работния флуид с топлообмен; за четири неговия предишен процес са особени случаи.
Изохорен или изохорен процес (от старогръцки. # 943; # 963; # 959; # 962; - "равен", и # 967; # 974; # 961; # 959; # 962; - "пространство, заето пространство") - е термодинамичен процес, който настъпва при постоянен обем. За изпълнение изохорен процес в газова или достатъчно течност за нагряване (хладно) вещество в съд, който не променя изохорен процес oboma.Pri идеален газ под налягане е право пропорционална на температурата. В реалния закон газ Чарлз не се извършва.
В графиките изобразен линии, които се наричат isochors. За идеален газ, те са директно във всички диаграми, които се свързват параметри: Т (температура), V (обем), и Р (налягане).
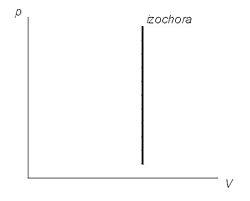
Графика изохорен процес диаграма (Р V)
От определението на работата, че промяната в експлоатация при изохорен процес е:
За определяне на цялостното изпълнение на този процес, ние се интегрира този израз. Тъй като обемът е непроменена, тогава:
Въпреки това, като неделима е нула. Така че, когато изохорен процес газ не работи:
Графично, че е много по-лесно да се докаже. От математическа гледна точка, процесът на работа - е площта под графиката. Но изохорен процес график е перпендикулярна на оста х. По този начин, площта под е nulyu.Izmenenie вътрешната енергия на идеалния газ може да се намери от формулата:
където I - броят на степените на свобода, който зависи от броя на атомите в молекулата (за едноатомен 3 (например, неон), 5 до двуатомен (например, кислород) и 6 за триатомен или повече (например, молекула на водна пара)).
Определението и специфичната топлина с формула и формула за вътрешната енергия може да бъде презаписано, както следва:
където - моларното топлина капацитет при постоянен обем.
С помощта на първия закон на термодинамиката може да се намери, когато количеството топлина изохорен процес:
Но изохорен процес газ не се върши работата. Това означава, че важи следното уравнение:
тоест, цялата топлина, която получава газ отива до промяна във вътрешната си енергия.