Как да намерите най-енталпия на реакция
Някои химични реакции могат поглъщат или излъчват топла среда. Такова прехвърляне на топлина между химическата реакция и околната среда, се нарича енталпия или Н. Въпреки това, не е възможно за точно измерване на енталпията промяната разчита следователно взети температура на околната среда (означен АН). АН показва, че химическата реакция топлина на освобождаване в околната среда (екзотермична реакция) или абсорбция на топлина (ендотермична реакция). Енталпия се изчислява като: ьН = m х и х АТ, където m - е теглото на реагентите, S - е специфичната топлина, АТ - температурна разлика е.
стъпки Редактиране
Метод 1 от 3:
Изчисление на енталпията Редактиране


- Например, необходимо е да се намери енталпията на реакция на образуване на вода от кислород и водород: 2Н2 (водород) + 2 (кислород) → 2Н2 О (вода). В тази реакция, Н2 и O2 - това реактиви и Н2 О - продукт на реакцията.


- В нашия пример, реагентите, водород и кислород, имат молекулни тегла двеграма и 32 г, съответно. Тъй като ние използваме 2 мола водород (коефициента в химична реакция преди Н2 за водород) и 1 мол кислород (липса на коефициента на O2 е 1 мол), общата маса на реагентите се изчислява както следва:
2 х (2г) + 1 х (32гр) = четири грама + = 32гр тридесет и шест грама


- Моля, имайте предвид, че ако имате няколко продукта на реакцията, е необходимо да се изчисли от топлинната мощност на всеки от тях и след това да ги добавите, за да получите енталпия на реакцията.
- В нашия пример, реакционен продукт - водата, която има специфична топлина на 4.2 J / г ° С


Намери температурната разлика. Сега ние откриваме ATi, - изменение на температурата преди и след реакцията. От изходния температура (Т1) се изважда крайната температура (Т2). Често използвани Келвин скала (К) за засичане на температурата (по Целзий (° С) до получаване на същия резултат).
- В нашия пример, нека да приемем, че първоначалната температура на реакция беше 185K и 95К след реакцията започна, затова ,? T се изчислява, както следва:
АТ = Т2 - Т1 = 95К - 185K = -90K


- В нашия пример, енталпията се изчислява, както следва:
АН = (тридесет и шестграм) х (4.2 DzhK-1 G-1) х (-90K) = -13,608 J.


- В нашия пример, крайният резултат е равен на -13608 J. Преди енталпия отрицателна стойност, което означава, че реакцията е екзотермична. Горещ газ (като пара) Н2 и О2 трябва да разпредели определено количество топлина, за да се образува молекула вода, реакционната т.е. Н2 О формация е екзотермична.
Метод 2 на 3:
Изчисление на енталпията Редактиране


- Например да приемем, реакцията: H2 + F2 → 2Hf. В този случай на енергия, за да се прекъсне връзката в молекулата на Н2 е 436 кДж / мол, и разликата енергия за F2 е 158 кДж / мол. [1] Накрая, енергията, необходима за образуване на връзка в молекулата HF от Н и F = -568 кДж / мол. [2] Наскоро умножава стойност от 2, тъй получи по време на реакцията 2 мола HF, т.е. 2 х -568 = -1,136 кДж / мол. Добавя стойност:
436 + 158 + -1136 = -542 кДж / мол.


- Например да разгледаме следната реакция: С2 Н5 OH + 3O2 → 2CO2 + 3H2 О. Знаем, че енталпия на образуване се изчислява: [3]
С2 Н5 ОН → 2С + 3H2 + 0.5O2 = 228 кДж / мол
2С + 2O2 → 2CO2 = -394 х 2 = -788 кДж / мол
3H2 + 1.5 О2 → 3H2 О = -286 х 3 = -858 кДж / мол
Сега добавите номера на свързани вещества, получени по-горе за определяне на енталпията на реакцията: С2 Н5 ОН + 3O2 → 2CO2 + 3H2 О,
228 + -788 + -858 = -1418 кДж / мол.
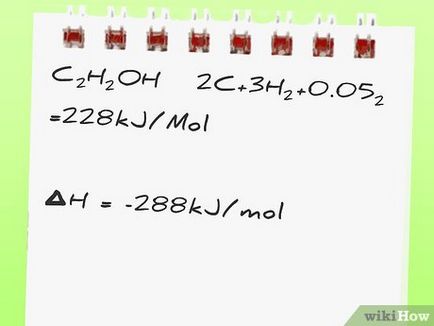

- В примера, имайте предвид, че реакцията на образуване на С2 Н5 ОН продукт записва обратно. С2 Н5 ОН → 2С + 3H2 + 0.5O2 т.е. С2 Н5 ОН разгражда, отколкото синтезирани. Следователно, знакът пред енталпията в положителна реакция 228 кДж \ мола, въпреки енталпията на образуване на С2 Н5 ОН е -228 кДж \ мол.